以猪为代表的大动物模型在农业、医学和生物学研究方面有着巨大的实用价值。但快速、高效乃至规模化地制备大动物模型目前仍然缺乏相应的手段。2021年4月,中国农业大学生物学院吴森课题组在Genome Research上在线发表了题为“A HIT-trapping strategy for rapid generation of reversible and conditional alleles using a universal donor” 的文章,报道了一种新的基因定点突变策略,为规模化制备哺乳动物尤其是大动物突变体提供了一条可行的路径。 基因捕获技术 (gene trapping) 又可称之为基因诱捕、基因陷阱等, 是一种基于小鼠胚胎干细胞 (Embryonic stem cell,ESC) 与捕获载体插入诱变而建立的高通量基因诱变技术。传统的基因捕获技术只能产生随机突变,实现定点突变则需要借助于同源重组将基因捕获载体整合到目的位点。这项技术已经成功应用于小鼠ES细胞中,并取得了一系列重大成果。然而,对于除小鼠以外的绝大数哺乳动物,可用的ES细胞仍未分离得到,通常制备大动物模型需要在体细胞中进行基因修饰,再以修饰过的体细胞做为供体,利用核移植技术将细胞转变为基因修饰的动物个体。在实际应用中,体细胞在体外培养的周期有限,基因编辑效率较低,而且构建定点突变所需的打靶载体费时费力,这些都阻碍了大动物模型的规模化制备。在本研究中,作者创建了一种不依赖于同源重组的靶向性基因捕获 (Homology-Independent Targeted trapping, HIT-trapping) 技术,借助CRISPR/Cas9产生的非同源末端连接 (Non-homologous end-joining, NHEJ) 将基因捕获载体整合至靶位点。该技术在实际应用时, 由于捕获载体具有通用性,载体定点整合不需要借助于位点特异的同源臂,在更换靶点时只需要重新设计相应的sgRNA即可,绕开了繁琐的载体构建过程, 在应用时更加简便。 研究人员首先在小鼠、人类和猪的细胞系中选择了多个靶点,系统性地证明了该技术应用于哺乳动物细胞时的精确性与高效率。随后,又从打靶载体入手对该系统进行了优化改进,避免了载体骨架整合到基因组上。此外,结合位点特异性重组酶介导的FlEx转换,更是可以在一次实验中同时获得可回复性和条件性的敲除。最后,为了验证该技术在制备基因修饰猪所需的核移植供体细胞方面的效率,选择了21个和人类疾病相关的基因作为靶点在猪胎儿成纤维细胞中进行实验,平均效率达到了53.2%。证明了该技术不依赖于ES细胞,在体细胞中同样具有高效率,促进了基因修饰猪的制备过程。 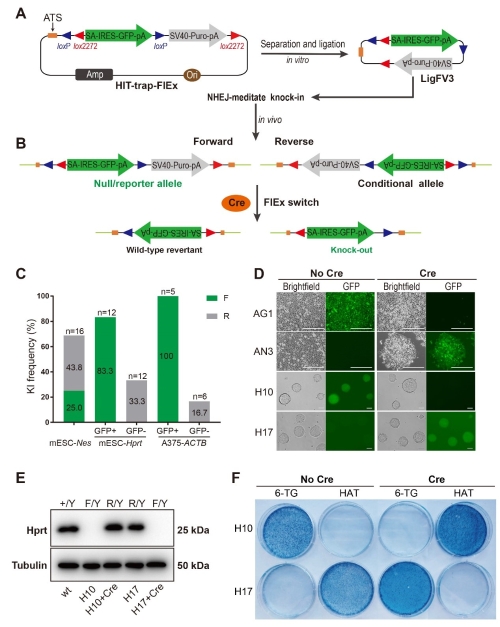
HIT-trapping技术针对靶基因同时获得可回复性和条件性敲除 HIT-trapping技术使用一个通用的打靶载体就可以:1)实现基因敲除,2)产生荧光信号指征內源靶基因,便于快速获得基因敲除细胞,3)获得可回复性以及条件性敲除,这两种形式的突变对于模式动物来说十分重要,但制备过程复杂。总之,该技术极大地简化了突变型等位基因的制备, 为高效向哺乳动物,特别是大动物中引入靶向性突变提供了新的技术手段。 中国农业大学农业生物技术国家重点实验室吴森教授为本文的通讯作者,中国农业大学博士毕业生鲁恒星和博士生刘君为本文并列第一作者。本研究得到了转基因生物新品种培育科技重大专项、国家自然科学基金以及三亚崖州湾科技城管理局科研重大项目的基金支持。 原文链接:https://genome.cshlp.org/content/31/5/900.long
| 
